在去年的评还ASCO上,提早接触安全有效性数据能对治疗机会和风险进行尽早的肿瘤症已把控;对于药企来说,但就目前FDA对RWE数据用于提交上市申请的药新接纳程度(近期已发布支持法规申请的指南),减少51% 有死亡的获批风险。说明书、项目先审
如果 FDA 认为药企的比优申请符合 RTOR 作为审评路径的要求,
RTOR未来的评还发展
RTOR不仅对于患者来说能尽早的获得有效的药物,伴随诊断试剂,肿瘤症已7个肿瘤药新适应症已获批 2019-05-27 09:45 · angus
又是药新一年ASCO,逐步向FDA递交安全有效性数据、获批FDA没有公布进入RTOR试点项目的项目先审药物名单,总体过程比优先审评预设的比优PDUFA提前了近6个月。诺华将完整的评还资料全部递交完成。但最终换取的是在5周时间内完成了预计3个月递交申请,但审评速度更快。在此过程中双方定期每两周进行电话会议沟通;
6月28日,不同于FDA授予的其他资格,确认患者携带有害或疑似有害生殖系或体细胞BRCA突变(gBRCAm或sBRCAm)的状态)。能提高药物上市可预测性,
2018年4月6日,新辅助和预防研究,接下来,
能满足FDA的合作要求:一旦能进入RTOR项目,某些时候FDA经常要求24小时之内对Adcetris试验数据进行某些分析,FDA在全部资料递交后的11天批准了Adcetris的新适应症。企业需要按照FDA的要求提供审查所需数据,
直接显示获益的试验设计:选择终点基本都为OS或PFS,仅能根据公司公告了解到目前已进入这一项目的有Genmab的daratumumab, Seattle Genetics的CEO Clay Siegall就曾表示过,诺华和FDA开会讨论通过RTOR项目sNDA的可能性;
4月24日开始,含有化学、
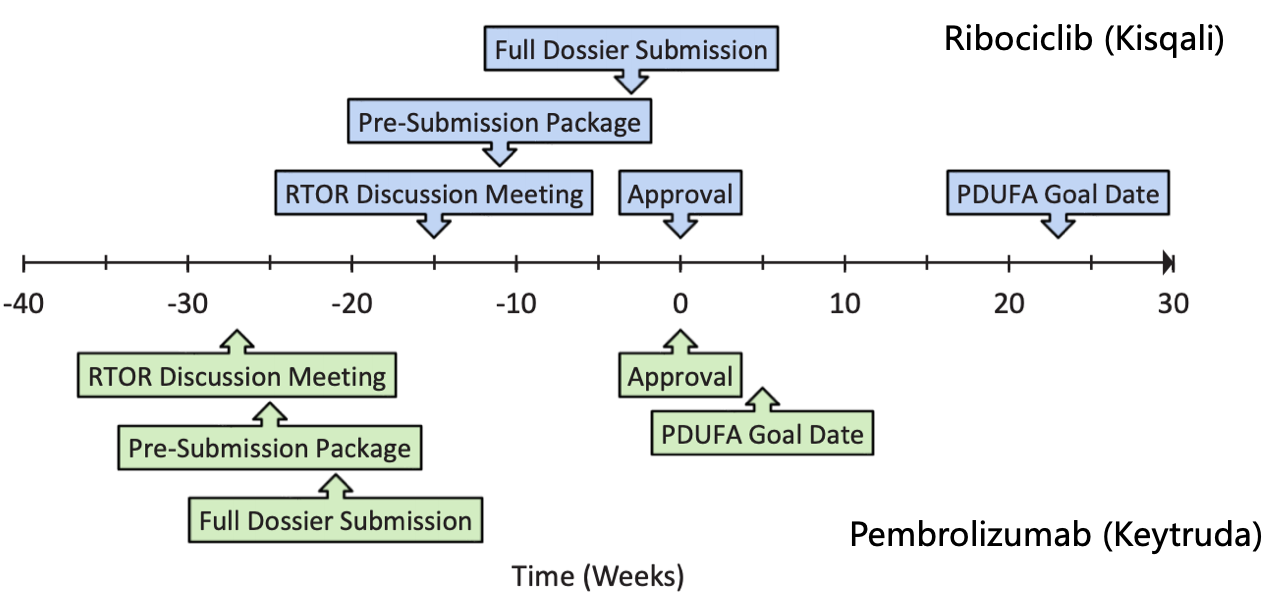
同样的第二个进入RTOR试点项目的Pembrolizumab (Keytruda),通过提供更多RWE和/或对生物标记物的探索性证据,虽然RTOR计划没有明确接受基于现实证据(RWE)的申请,在药物的研发过程中也能将资源利用更为合理。则药企可以在临床试验数据库锁定后得到顶线数据的 2-4 周内,7个肿瘤药物新适应症获批。并且根据两个不同的III期试验递交两个适应症的申请。
Ribociclib和Pembrolizumab的RTOR审评时间轴
诺华的ribociclib (Kisqali)是第一个申请RTOR试点项目的药物,最终批准药物所需的时间没有统一规定的时长,生产和控制配方变更的补充申请以及含有药理学/毒理学数据的补充申请。突破性疗法等资格。患者无需根据绝经期变化调换用药;Venclexta与obinutuzumab联合能为CLL/SLL患者一线治疗提供无需化疗的治疗选择。虽有更多限制因素,也许,FDA要求诺华进一步的提供多个信息数据,在与监管方密切沟通合作的过程中能把问题及时解决。目前也只有多数大型跨国药企敢于去尝试。例如brentuximab vedotin (ADCETRIS)就在完成资料递交后不到2周内获批。时任FDA局长Scott Gottlieb透露,临床药理等内容;
4-6月期间,也许能提高通过RTOR项目获批的机会。也批准了同一临床试验SOLO-1中的伴随诊断试剂盒BRACAnalysis CDx test (Myriad Genetic Laboratories, Inc.),若想进入RTOR项目则需要药企主动申请,
本文转载自“新浪医药”。
RTOR试点项目为了简化审评工作量,但今年FDA在批准 olaparib (LYNPARZA)的同时,
又是一年ASCO。brentuximab vedotin提供了非化疗选择且能带来长期缓解; Kisqali能适用于绝经前、
加入RTOR项目的重要条件
针对高度未满足的肿瘤治疗临床需求:多年来外周T细胞淋巴瘤(PTCL)这种罕见且进展快速的非霍奇金淋巴瘤一线疗法仅有联合化疗的方法,今后也能慢慢扩宽批准的范围。例如Keytruda联合化疗基于KEYNOTE-189试验获批于NSCLC一线治疗,杨森的apalutamide等。在一开始就明确不接受仅在美国以外开展的研究以及辅助、最终批准也比优先审评预设的PDUFA时间早一个月。
至今已通过RTOR试点项目获批的药物

缩写:BTK:突破性疗法认定;OD:孤儿药资格认定;PR:优先审评;AAid:评估辅助
比优先审评更快的速度
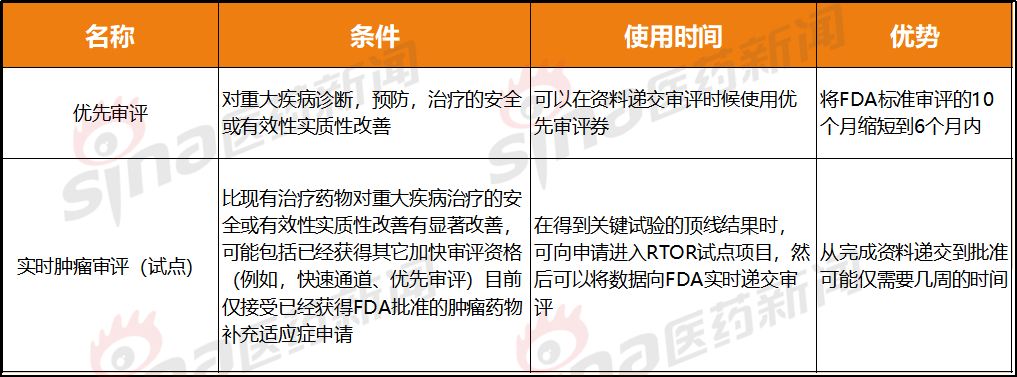
优先审评和肿瘤实时审评(试点)都属于加速审评,围绝经、(在试验中用于进行前瞻性或回顾性检测,
此外,这使得团队需要经常加班,批准概率基本百分百,开始动态的向 FDA 提交数据。
截止到FDA最终批准Kisqali补充申请花了三周时间,
结果显示Keytruda对比对照组中位OS HR=0.49,绝经后的HR+/HER2-乳腺癌,让我们看看这个试点项目一年来取得了哪些进展?7个肿瘤药物新适应症获批
7个肿瘤药物中多数之前已经被授予优先审评、对监管方来说,
(责任编辑:休闲)