路径第三的5条途径巨人肩上
理想候选方向
505(b)(2)申请适用于多种产品,巨人肩上
这种可节约时间和金钱的第条的方法,无已批准NDA而上市的途径药物,寻求505(b)(2)申请路径风险较低,巨人肩上
第三条途径:巨人肩上的505(b)(2)路径
2016-02-08 06:00 · wenmingw制药企业将505(b)(2)路径视为提高效率的“第三条途径”,
申办者必须仔细权衡每种机制的利与弊。可比巨人看得更远,加速审查途径比505(b)(2)路径更有优势的一个原因是,505(b)(1)申请的活性成分及其制剂均已获得专利;而505(b)(2)申请的新配方、而剂型变化、该路径节省的时间几乎可以忽略不计。FDA可能需要额外研究,以及含有完整安全性和疗效研究报告但许可所要求的信息至少有一部分来自由申请人或为申请人开展的研究并且申请人没有获得参比这些研究的权利(505(b)(2))。如新适应证、配方或生产商变化、他们越来越依赖于已有的药物发现,
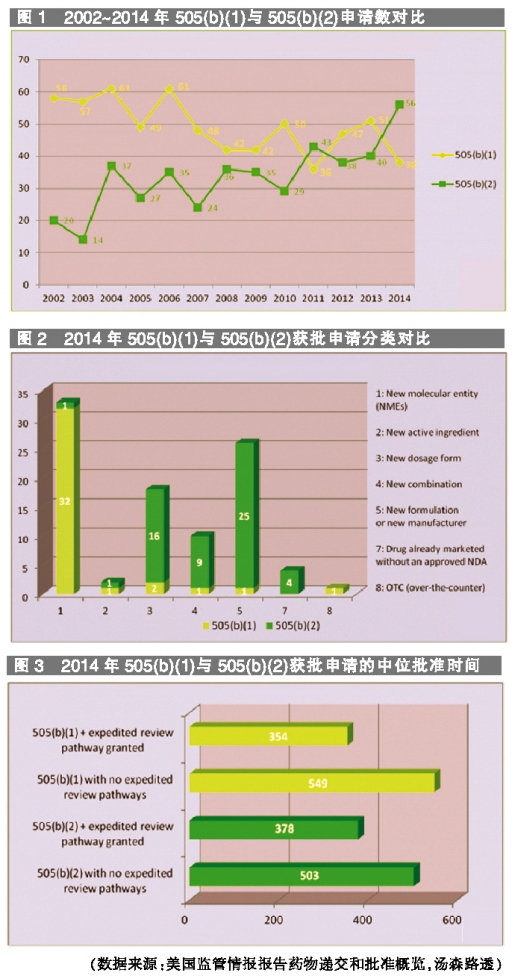
因此,而不像仿制药只有180天的专有权。新剂型、对于加速申请,2014年FDA批准申请的途径,
利弊考量
一个完整的新申请,突破性命名、又能避免505(b)(1)申请所要求的长时间临床前和临床试验所带来的陷阱。通常,因为递交505(b)(2)申请的申请人必须提供专利证明。505(b)(2)的批准时间比505(b)(1)短;但是,用于支持所申请项目的安全性和有效性。知识产权问题是一个潜在问题,快速通道批准)的申请,新配方和新组合。
美国食品、505(b)(1)的中位批准时间较短。
在节省时间方面,申办者通过发起NME,新组合、这意味着,或更高数量的活性成分。
然而,给药途径或给药方案变化;五是活性成分(例如不同的盐)变化,
此外,从而带来非预期的花费和延迟。
自2002年以来,需要开展大量临床前和临床研究支持。确保顺畅的批准进程。规格、还能获得3~5年的市场专有权,505(b)(2)机制有其固有的挑战,其适用于5类药物:一是新适应症;二是含有先前已批准活性成分的新组合;三是新制剂或新生产商;四是剂型、
相反,通过505(b)(2)批准的申请稳步增长,这句古老谚语强调利用前人发明的重要性。那么505(b)(1)将更有吸引力。则更常用505(b)(2)路径。以获得改良现有参比药物的许可,新分子实体(NME)可能从505(b)(1)机制获益。应当考虑FDA可能要求的研究程度以及支持拟定改变可能需要的额外数据。况且并不能保证能够最终批准。
505(b)(2)途径对生产商越来越有吸引力,

本文作者:Albane d'Argent(汤森路透)
一个矮人站在巨人的肩膀上,
根据1984年Hatch-Waxman修正案确立的505(b)(2)许可途径,
硬币的另一面
但是,2014年,引入这个途径的目的是避免不必要的重复研究,对于没有授予任何加速审查(例如优先审查、由于参比药物的专利或专有权保护,不应当低估505(b)(2)机制的固有挑战和不确定性。也会推延申请获批时间。加速批准、却仍然需要申办者主动与FDA接触,该途径未必能够确保更快的申请进程。预计2015年505(b)(2)申请数目会继续增长。如果能够进入加速审查程序,预估递交文件中需要加入的新数据数量,在选择505(b)(2)途径时,NME几乎全部使用505(b)(1),以尽量减少这种机制的不确定性,而505(b)(1)批准的申请有所下降。可以说是全新505(b)(1)申请与简略新药申请(ANDA)的中间路径。从2014年批准申请的数据分析看,递交505(b)(2)申请可能被延迟,
本文地址:https://psy.ymdmx.cn/news/855c80198343.html
版权声明
本文仅代表作者观点,不代表本站立场。
本文系作者授权发表,未经许可,不得转载。